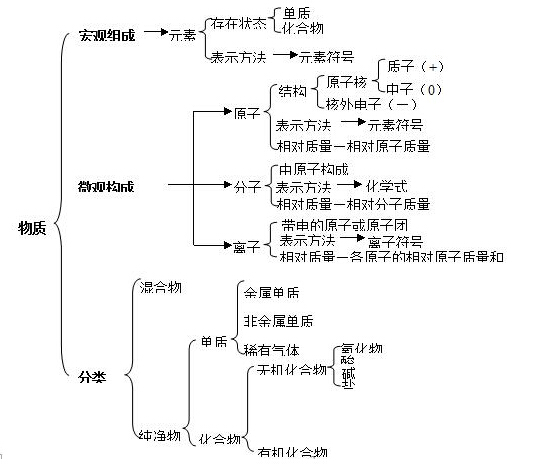
2017年中考复习开始,21世纪教育网提供最新2017年中考各科复习资料汇总,为了方便大家的大一轮复习,下面是小编为大家整理的2017中考化学知识点总结:物质的分类,包含最新考点内容,非常适合大家复习参考,欢迎进入查看! 为了便于大家的理解,21世纪教育网还推出了视频教学课程,对中考必考知识点进行详细讲解与分析,对于同学们的学习提高很有帮助,点击以下图片或链接直接进入观看! 《《《2017中考化学知识点分类复习》》》 物质的分类
3.混合物:是由两种或两种以上的物质混合而成(或由不同种物质组成) 例如,空气,溶液(盐酸、 澄清的石灰水、碘酒、矿泉水)矿物(煤、石 油、天然气、铁矿石、石灰石),合金(生铁、钢) 注意:氧气和臭氧混合而成的物质是混合物,红磷和白磷混合也是混合物。 纯净物、混合物与组成元素的种类无关。即一种元素组成的物质可能是纯净物也可能是混合物, 多种元素组成的物质可能是纯净或混合物。 4.纯净物:由一种物质组成的。 例如:水、 水银、 蓝矾(CuSO4 ·5H2 O)都是纯净物 冰与水混合是纯净物。 名称中有“某化某”“某酸某”的都是纯净物,是化合物。 5.单质:由同种(或一种)元素组成的纯净物。例如:铁 氧气(液氧)、氢气、水银。 6.化合物:由不同种(两种或两种以上)元素组成的纯净物。名称中有“某化某”“某酸某”的是化合物。 7.有机物(有机化合物):含碳元素外的化合物(除CO、CO2 和含碳酸根化合物外) 无机物:不含碳元素的化合物以及CO、CO2 和含碳酸根的化合物 8. 氧化物:由两种元素组成,其中一种是氧元素的化合物。 a. 酸性氧化物:跟碱反应生成盐和水的氧化物CO2 ,SO2 ,SO3 b. 大部分非金属氧化物都是酸性氧化物,跟水反应生成同价的含氧酸。 CO2 + H2O= H2CO3 SO2 + H2O= H2SO3 SO3 + H2O= H2SO4 b.碱性氧化物:跟酸反应生成盐和水的氧化物。CaO Na2 O MgO Fe2 O3 CuO 大部分金属氧化物都是碱性氧化物, BaO K2 O CaO Na2 O溶于水立即跟水反应 生成相应的碱,其他碱性氧化物不溶于水,跟水不反应。 CaO+H2O=Ca(OH)2 BaO+H2O=Ca(OH)2 Na2O+H2O=2NaOH K2O+H2O=2KOH c.注意:CO和H2 O既不是酸性氧化物也不是碱性氧化物,是不成盐氧化物。 9.酸:电离时生成的阳离子全部是氢离子的化合物。酸溶液的PH值小于7 酸的名称中最后一个字是“酸”,通常化学式的第一种元素是“H ”,酸由氢和酸根离子组成 紫色石蕊试液遇酸变红色,无色酚酞试液遇酸不变色 根据酸的组成,通常有以下两种分类方法:酸的电离方程式:酸=nH+ +酸根离子n- a.根据酸分子电离所能生成的氢离子的个数分为:一元酸(HCl、HNO3 )、 酸 二元酸(H2 SO4 、H2 S、H2 CO3 )和三元酸(H3 PO4 ) b.根据酸分子里有无氧原子分为: 含氧酸(H2 SO4 ,HNO3 ,H3 PO4 名称为:某酸) 无氧酸(HCl, H2 S名称为:氢某酸 ) 鉴定酸(鉴定H+ )的方法有:①加紫色石蕊试液变红色的是酸溶液; ②加活泼金属Mg、Fe、Zn等有氢气放出 10碱:电离时生成的阴离子全部是氢氧根离子的化合物。碱通常由金属离子和氢氧根离子构成。溶碱有五种:钾钙钠钡氨(KOH,Ca(OH)2 ,NaOH Ba(OH)2 ,氨水)它们的溶液无色。 有颜色的碱(不溶于水):红褐色的氢氧化铁(Fe(OH)3 ↓ )、蓝色的氢氧化铜(Cu(OH)↓) 其他固体碱是白色。碱的名称通常有“氢氧化某”,化学式的最后面是“OH” 可溶性碱的溶液PH值大于7,紫色石蕊试液遇溶碱变蓝色,无色酚酞试液遇溶碱变红色 鉴定可溶性碱溶液(鉴定OH- )方法一:加紫色石蕊试液变蓝色,加无色酚酞试液变红色是碱. 方法二:加铁盐溶液有红褐色沉淀生成;加铜盐溶液有蓝色沉淀的是碱。 11.盐:电离时生成金属离子和酸根离子的化合物。 第一种分类方法: a.正盐(酸碱完全中和的产物,没有可电离的氢离子或氢氧根离子),例如 NaCl、Na2 S ,KNO3 无氧酸正盐叫 “某化某”Na2 S_______ MgCl2__________FeS__________ 含氧酸盐叫“某酸某”KNO3_________ BaSO4______________Na2CO3______ b.酸式盐(多元酸里的氢部分被金属取代,H夹在中间) NaHCO3____________ 、 Ca(HCO3 )2_____________、NaH2 PO4 _____________ 常见的酸式盐的酸根有:HCO3 - 、HSO4 - 、H2 PO4 - 、HPO4 2- c.碱式盐(化学式的中间有“OH”):Cu2 (OH)2 CO3 第二种分类方法 按盐中相同部分的离子称为某类盐:含碳酸根离子的盐称为碳酸盐、含硫酸根离子的盐称为 硫酸盐、含硝酸根离子的盐称为硝酸盐、含铁离子的盐称为铁盐,等等。 12.酸碱指示剂(石蕊试液、无色酚酞)和PH值: 酸溶液的PH值小于7(如盐酸、稀硫酸、硝酸),酸性越强PH值越小,酸性越弱PH值越大。水、中性的硫酸盐、硝酸盐和盐酸盐溶液不能使指示剂变色,PH值等于7。不能使指示剂变色;可溶的碱溶液PH值大于7。碱性越强PH值越大,碱性越弱PH越小 13.酸碱盐溶解性口诀:钾钠硝铵溶 溶碱有五种 :钡钾钙钠氨 不溶氯化物AgCl 不溶硫酸盐BaSO4 碳酸盐只溶钾钠铵 口诀的含义:含有钾、钠、硝酸根、铵根的物质都溶于水 溶于水的碱有:氢氧化钡、氢氧化钾、氢氧化钙、氢氧化钠 和氨水,其他碱不溶于水 含Cl的化合物只有AgCl不溶于水,其他都溶于水;含SO42- 的化合物只有BaSO4 不溶于水,其他都溶于水。含CO32- 的物质只有含K+ Na+ NH4+溶于水,其他都不溶于水 14.沉淀物中AgCl和BaSO4 不溶于稀硝酸,Fe(OH)3是红褐色沉淀,Cu(OH)2是蓝色沉淀 其他沉淀是白色(包括Fe(OH)2)有以下常见的沉淀:Mg(OH)2 Al(OH)3 CaCO3 BaCO3 Ag2 CO3 推断题中,往沉淀物加稀硝酸:若讲沉淀不溶解,则沉淀中一定有AgCl或BaSO4 ;若讲沉淀 全部溶解,则沉淀中一定没有AgCl或BaSO4 ;若讲沉淀部分溶解,则沉淀中一定有AgCl或BaSO4 中的一种,且还有另一种可溶于稀硝酸的沉淀。 Tags:2017,中考,化学,知识点,总结  |
21世纪教育网,面向全国的中小学学教师、家长交流平台